学术论文丨骨形态发生蛋白-2在兔骨折愈合过程中的作用

骨折愈合是一个复杂的动态过程,多种细胞参与了愈合过程,而相关细胞分泌的大量细胞因子也参与其中,共同促成骨折的愈合。骨形态发生蛋白(BMP-2)在骨折愈合中具有重要的作用,可促进骨痂形成,加速骨折愈合,且其成骨量与BMP-2浓度成正比,与扩散距离成反比。若骨折移位明显,骨折端距离足够大,内源性BMP-2的量及其分布将难以起到诱导趋化的作用,因此,外源性BMP-2的补充应用将弥补内源性BMP-2的不足[1]。本实验利用兔建立骨折模型,将外源性BMP-2用于兔桡骨骨折断端,以探讨BMP-2对骨折愈合的影响及机理,同时对BMP-2在骨折愈合过程中与VEGF和TGF-β1表达的作用关系进行观察,为BMP-2的临床应用提供理论基础。
1 材料与方法
1.1 骨折模型建立与实验处理
健康雄性新西兰大白兔30只(济南西岭角种兔养殖繁育中心提供,许可证号SCXK鲁20100005),体质量(2.5±0.5)kg。将30只家兔随机分为实验组和对照组,每组15只,氯胺酮8mg/kg腹腔注射麻醉,常规脱毛,参照Farso Nielsen方法[2],无菌条件下行右前肢中下段外侧纵行切口约1cm,暴露桡骨。用直径0.5mm牙科磨钻横行离断桡骨,止血、冲洗、缝合切口。实验组兔于切口缝合前在骨折处注射BMP-2(北京中科物源生物科技有限公司),注射剂量1μg/kg; 对照组兔在骨折处注射生理盐水。两组实验动物术后均不需固定,术后连续3d肌肉注射青霉素,每次80万U,每天1次。
1.2 观察方法
1.2.1 X线影像评分 两组动物分别于骨折术后1、2、3、5、7周随机各选取3只,分别摄前肢X线片。X线片拍摄条件为: 60.5kV、24mAs、1.25m。每张X线片均由3名骨科医生分别进行评分,取平均值,评分标准[3]如下,1分: 骨折断端边缘趋向模糊,骨膜轻度反应,无骨痂生成; 2分: 断端边缘模糊,骨膜反应浅淡,骨痂少量,密度较淡,边缘不整齐; 3分: 断端边缘仍可见,但接近消失,骨膜反应较深,骨痂量增多,但尚未填满缺损区,密度增深,边缘较清;4分: 断端边缘完全消失,骨膜反应密度近似骨影,骨痂填满缺损区,与骨皮质密度相同并相互连接。
1.2.2 组织学与免疫组织化学 拍片后处死兔子,以骨折处为中心取桡骨段1.5cm,剔除软组织,用4%多聚甲醛溶液固定2d,后放入200g/L的EDTA液中,在微波下脱钙,50℃每天1h,脱钙结束后更换脱钙液,于室温下继续脱钙,2d后骨组织完全脱钙,进行冰冻切片,厚度5μm,行常规HE染色及免疫组化染色,后者方法如下:
将切片PBS缓冲液冲洗,室温下置于3%H2O2溶液中10min,用蒸馏水冲洗,再次用PBS冲洗5min,滴加复合消化液37℃孵育10min,PBS再次浸泡5min,滴加抗原修复液37℃孵育10min,单蒸水冲洗,PBS浸泡5min。5%正常山羊血清封闭20min,去除表面血清,滴加鼠抗兔VEGF、TGF-β1、BMP-2抗体(抗体均1:100稀释),4℃冰箱过夜。PBS冲洗,滴加山羊抗鼠IgG工作液,DAB显色剂显色,单蒸水冲洗,复染,封片,显微镜下观察,拍照。
显微镜下肉眼观察两组切片BMP-2、VEGF、TGF-β1表达情况,并进行比较。细胞核或胞浆内出现棕黄色颗粒染色的为阳性细胞,每张切片随机选取5个高倍视野(×400),高分辨率相机拍照后将图像输入计算机储存,使用Image-Pro-Plus IPP6.0医学病理图像分析系统进行半定量分析,计算每个视野的累积光密度值和累积阳性面积值,两者比值为该视野平均吸光度值,取每张切片5个视野的平均值。
1.3 统计学分析
采用SPSS 13.0统计学软件进行数据分析,计量资料以(x̄±s) 表示,相同时间实验组与对照组比较采用独立样本t检验,P<0.05 为差异有统计学意义。
2 结 果
2.1 X线影像评估
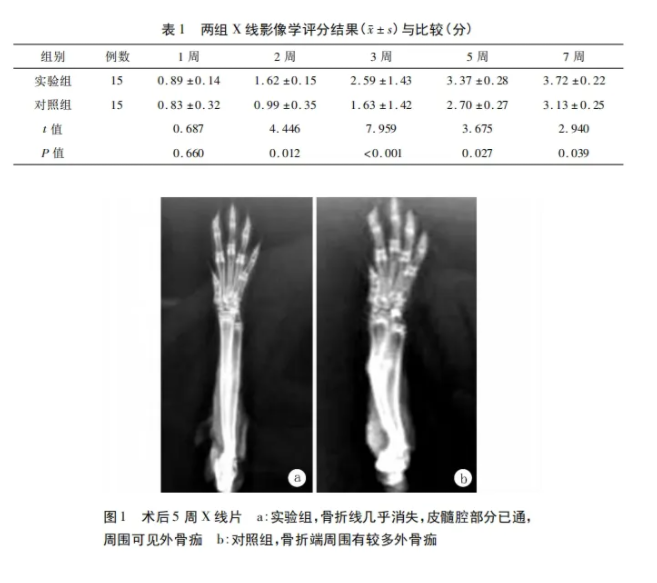
术后1周X线片: 实验组与对照组均无骨痂生长。术后2周X线片: 实验组骨痂明显生长; 对照组几乎无骨痂生长,两组间评分差异有统计学意义(P<0.05)。术后3周X线片: 实验组骨折线已模糊不清,骨折端周围可见连续骨痂生长; 而对照组骨折线仍清晰可见,骨折端周围少许骨痂生长,两组间评分差异有统计学意义(P<0.05)。术后5周时X线片: 实验组骨折线几乎消失,皮髓腔部分已通,周围可见外骨痂; 对照组骨折端周围有较多外骨痂(图1),两组间评分差异有统计学意义(P<0.05)。术后7周X线片: 实验组骨折线已消失,皮质连续,髓腔贯通,周围有少许外骨痂; 对照组皮质不连续,髓腔部分贯通,两组间X线影像评分的差异仍有统计学意义(P<0.05)。不同时间点两组X线影像评分结果与比较详见表1。
2.2 HE染色观察
术后3周: 实验组骨折处可见骨性骨痂排列整齐,骨痂致密,成骨细胞及破骨细胞较多、较大,软骨内可见化骨现象; 对照组骨痂排列紊乱、稀疏,软骨细胞大、多,聚集岛状。术后5周: 实验组骨折处髓腔已部分再通,骨痂排列整齐,破骨细胞较多; 对照组骨折处髓腔仍未通,有骨痂充填,骨痂较稀疏、破骨细胞少,排列紊乱。至术后7周,实验组骨折处髓腔已再通,出现板层骨,少许破骨细胞; 对照组髓腔仍未通,骨折端和外骨痂处仍可见较多破骨细胞及纤维软组织。
2.3 免疫组化染色结果
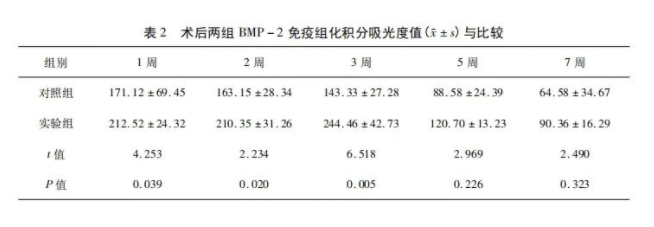
2.3.1 BMP-2染色结果 骨折术后1、2周,对照组及实验组骨折端均有显色,实验组较对照组显色较深,差异有统计学意义(P<0.05)。骨折术后3周,实验组及对照组骨折端亦均显色,实验组显色明显较对照组深(图2),差异有统计学意义(P<0.05)。骨折术后5、7周,均有较浅显色,但实验组及对照组显色无明显差异。不同时间点两组BMP-2免疫组化积分吸光度值结果与比较详见表2。

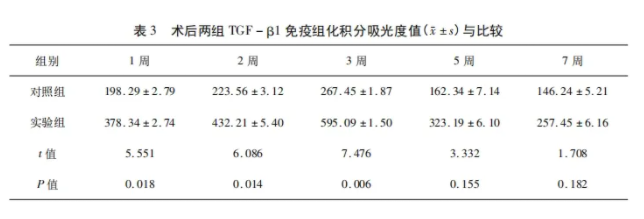
2.3.2 TGF-β1染色结果 骨折术后1、2周: 实验组及对照组成纤维细胞、炎性细胞及细胞外基质均有显色,实验组显色明显较对照组深,差异有统计学意义(P<0.05)。骨折术后3周: 实验组及对照组成骨细胞、软骨细胞及细胞基质均显色,实验组显色明显较对照组深(图2),差异有统计学意义(P<0.05)。骨折术后5、7周: 实验组及对照组成骨细胞及骨小梁表面均有显色,但较骨折1、3周显色明显变浅,但两组显色无明显差异。不同时间点两组TGF-β1免疫组化积分吸光度值结果与比较详见表3。
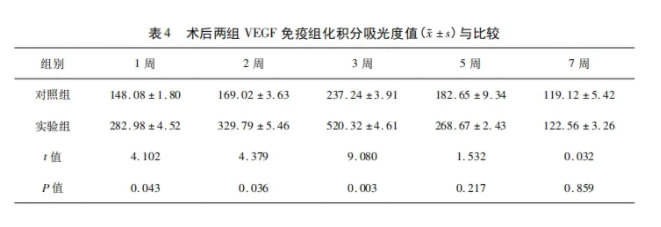
2.3.3 VEGF 染色结果 骨折术后3周:实验组及对照组中炎性细胞、软骨细胞、成纤维细胞及细胞外基质均有显色,实验组较对照组显色明显较深(图2),差异有统计学意义(P<0.05)。骨折术后5、7周: 骨细胞及成骨细胞VEGF表达阳性,细胞外基质有较浅显色,实验组及对照组显色无明显差异。同时间点两组VEGF免疫组织化学积分吸光度值结果与比较详见表4。
3 讨 论
骨折愈合是一个复杂的过程,有大量的细胞因子参与其中。自Urist等[4]提出诱导成骨理论以后,人们逐渐认识到一系列骨生长因子,如TGF-β1、BMP-2、bFGF、VEGF等与骨折愈合关系密切,其中BMP-2具有重要的促进骨形成作用,能跨种诱导未分化间充质干细胞向成骨细胞方向增殖和分化,促进成骨和骨折愈合[5-6]。本实验研究结果BMP-2、VEGF等的表达与文献[7]结论基本一致。由此可知,在兔骨折愈合中期,BMP-2能促进软骨钙化及软骨消散,使软骨形成期提前,通过促进成骨细胞的增殖与分化而促进成骨、骨痂生长及外骨痂桥接。在后期,BMP-2通过提高破骨细胞的活性与数量,促进板层骨的提早形成和髓腔的提前再通。新生连续骨皮质的形成以及髓腔再通,可以作为骨折组织学愈合的标准[8]。许多研究均发现BMP-2能促进成骨细胞的增殖与分化。Kempen等[9]研究发现BMP-2可以促使成骨样细胞的高表达,并且VEGF的产生与微环境中BMP-2的浓度呈正相关。王湛等[10]发现BMP-2可促进兔桡骨碱性磷酸酶的活性及Ⅰ型胶原蛋白的表达,表明其可促进成骨细胞的分化,这与本实验的结果相符。破骨细胞的功能大小、数目多少,直接影响骨折的愈合。本实验发现BMP-2能提高破骨细胞的数量与活性,促进骨痂的改建,促进板层骨的提早形成和髓腔的提前再通。Kaneko H等[11]研究发现BMP-2被证明在特定骨动态平衡的内环境下,有促进破骨细胞活性的功能。本实验发现在骨折愈合的中期,实验组的破骨细胞在数量上明显多于对照组,这就满足了骨质重建的需要,而在骨折愈合的后期,当骨痂已改建成板层骨、髓腔已再通时,实验组的破骨细胞在数量上明显少于对照组,因这时骨质重建已基本完成。
TGF-β是一多功能蛋白质,其中TGF-β1是骨重建的关键性因子,它可以刺激骨膜间充质细胞增殖、分化,促进成骨或骨细胞增生[12],在血肿机化期,血小板立即释放TGF-β1,能刺激骨膜生发层细胞使其增殖[13],同时,它可诱导间充质细胞向软骨细胞分化形成软骨组织[14],因此TGF-β1是骨折愈合的诱导因子,启动了骨折愈合过程。在大量合成TGF-β1时,BMP-2的释放使增殖的间质细胞向软骨细 胞和成骨细胞分化、增殖,后者也合成、分泌TGF-β1,而TGF-β1又刺激高分化的间质细胞、成骨细胞和软骨细胞表达BMP-2[15],BMP-2与TGF-β1相互诱导促进。在原始骨痂形成期及骨痂改造塑形期,TGF-β1的表达逐渐下降。本实验免疫组化染色结果发现,实验组在早、中期骨折愈合过程中TGF-β1的分泌量较对照组充足,且时相提前,说明外源性BMP-2促进了TGF-β1的合成、分泌,对照组TGF-β1的低表达或许是骨折延迟愈合的原因之一。
骨折愈合过程中良好的血液供应具有重要意义[16]。VEGF作为一种最强的能特异性促进血管内皮细胞生长和血管生成的诱导因子,在机体的生长发育、骨折愈合中的作用不可替代。本实验研究中,VEGF表达贯穿于骨折愈合的始终,在血肿机化期表达较弱,主要在骨细胞内; 在原始骨痂形成期,随着肉芽组织长入血肿,软骨细胞及成骨细胞侵入发生软骨内骨化及膜内骨化,同时,骨折端局部低氧也强烈刺激VEGF表达。炎性细胞、软骨细胞、成纤维细胞、细胞外基质均可检测到大量VEGF表达; 骨痂改造塑形期,其他血管生成因子增多及低氧状态改善,导致VEGF表达减弱。早、中期实验组比对照组VEGF含量增高,时间与骨形成时间一致,外源性BMP-2促进了VEGF的合成分泌,加速骨折愈合,其表达过程与本实验研究结果一致,并且在骨折3周(原始骨痂形成期),实验组和对照组的VEGF表达均较其他时期强。故笔者认为,BMP-2可通过促进VEGF表达而促进血管生成,从而促进骨折愈合。有文献报道,TGF-β1与VEGF之间有正协同作用,TGF-β1是VEGF的调控因子[17],本实验结果显示,骨折后TGF-β1出现以及到达高峰的时间均比VEGF有所提前,故认为,在骨折早期,外源性BMP-2诱导TGF-β1的增殖分化,而大量的TGF-β1又促进内源性BMP-2大量表达,进而促进VEGF及TGF-β1的表达,TGF-β1保障了骨祖细胞的来源和数量,BMP-2又能使骨祖细胞适时地转化为软骨细胞和成骨细胞,VEGF保障骨折愈合所需充足的血液供应,三者相互促进,相互协同,最终完成骨折修复。
参考文献
[1] 冯伟,万荣,邓廉夫.骨优导修复骨缺损的实验研究[J]. 中国中医骨伤科杂志,2004,12(5):6-9.
[2]Farso Nielsen F,Karring T,Gogolewski S.Biodegradable guide for bone regeneration.Polyuretbane membranes tested in rabbit radius defects[J].Acta Ortbop Scand,1992,63 ( 1) : 66-69.
[3] 上海市骨伤科研究所.伤科论文汇编[M].上海: 上海科技出版社,1964 :226.
[4]Urist MR, Delange RJ,Finerman GA.Bone cell differentiation and growth factors[J].Science,1983,220(4598) :680-686.
[5]Covender S,Ceimma C,Genent HK,et al. Recombinant human bone morphogenetic protein-2 for treatment of open tibial fractures : a pro- spective,controlled,randomized study of four hundred and fifty pa- tients[J].J Bone Joint Surg Am,2002,84( 12) : 2123-2134.
[6] Sawyer AA,Song SJ,Susanto E,et al.The stimulation of healing with- in a rat calvarial defect by mPCL -TCP / collagen scaffolds loaded with rhBMP-2[J].Bionuiterials,2009,30( 13) : 2479-2488.
[7] 杨毅,金格勒,唐周舟,等.复合骨在兔腰椎融合过程中相关基因表达调控的影响[J].中华实验外科杂志,2010,2 (27 ) : 245 - 247.
[8] 时光达,唐国杰.中药“接种Ⅰ号”促进骨折愈合作用的实验研究[J].中华医学杂志,1978,58 (11) :670.
[9]Kempen DH,Lu L,Heijink A,et al.Effect of local sequential VEGF and BMP-2 delivery on ectopic and orthotopic bone regeneration[J].Biomaterials,2009,30 :2816-2825.
[10] 王湛,许晓军,杨军,等.聚乙二醇-骨形态发生蛋白-2-聚乳酸/ 聚已内酯载基因仿生骨促进骨缺损修复的实验观察[J].中国医学杂志,2015,3 (24): 865-869.
[11]Kaneko H,Arakawa T,Mano H,et al.Direct stimulation of osteoclas- tic bone rcsorption by bone morphogcnctic protein(BMP)-2 and ex-pression of BMP receptors in mature osteoclasts[J].Bone,2000,27 (4) :479-486.
[12] Tatsuyama K,Maezawa Y,Baba H,et al.Expression of various growth factors for cell proliferation and cytodifferentiation during fracture re- pair of bone[J].Eur J Histochem,2000,44 :269-278.
[13] 姬洪全,党耕町.骨折愈合过程中转化生长因子β1表达的实验研究[J].中华外科杂志,1998,36(2) :72-73.
[14]Seyedin SM,Thomas TC.Purification and characrerization of two car-tilage-inducing factors from bovine demineralizal bone[J].Proc Natl Acad Sci USA,1995,82(8) : 2267-2271.
[15] Bourque WT,Hall BK,Gross M.A reproducible method for producing and quantifying the stages of fracture repair[J].Lab Anim Sci,1992, 42(4) : 369-74.
[16] Akeno N,Czyzyk -Krzeska MF,Gross TS,et al.Hypoxia induces vascular endothelial growth factor gene transcription in human osteo- blast-like cells through the hypoxia-induciblefactor-2alpha[J]. Endocrinology,2001,142(2) : 959-962.
[17]Garcia-Ramirez M,Toran N,Andalus P,et al.Vascular endothelial factor is express in human fetal growth cartilage[J].J Bone Miner Res,2000,15 (3) : 534-540.
文章来源:中国矫形外科杂志 第24卷第10期 2016年5月